在化学反应中,氧化剂和还原剂是两个重要且基本的概念。它们在反应中相互作用,促进了电子的转移,这也是化学反应中能量变化的基础。对于许多初学者来说,理解氧化还原反应及其相关概念可能会感到困惑。因此,掌握一些简单的口诀和记忆方法,可以帮助学生更轻松地理解这些复杂的化学过程。这篇文章将分为三部分,分别介绍氧化剂和还原剂的定义、特点,以及如何巧妙地记住它们。
一、氧化剂与还原剂的定义
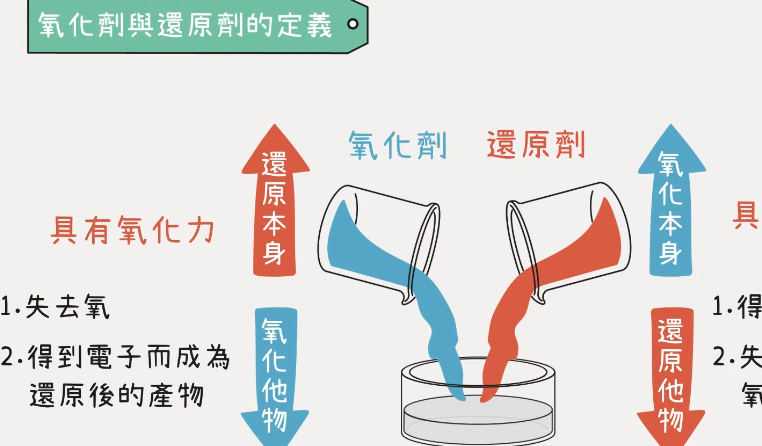
氧化剂和还原剂的定义源自于它们在化学反应中的角色和功能。
1.**氧化剂**:氧化剂是能够使其他物质发生氧化反应的物质。在这一过程中,氧化剂自身会被还原,也就是电子的失去。在常见的氧化剂中,例子包括氧气、氯气、高锰酸钾等。记住一点,氧化剂总是“氧化”某物质,并“自身”还原。
2.**还原剂**:还原剂则是能够使其他物质发生还原反应的物质。在这一过程中,还原剂自身被氧化,即电子的得到。常见的还原剂包括氢气、金属锌、铁粉等。可以这样记忆,还原剂总是“还原”某个物质,并“自身”氧化。
二、氧化剂与还原剂的性质
了解氧化剂和还原剂的性质,有助于我们在遇到具体化学反应时做出正确的判断。
1.**氧化剂的特点**:
-通常具有很强的电负性,容易吸引电子。
-它们在反应中带走电子,因此在反应后通常失去一定的氧化态(比如从+7降至+6)。
-在许多反应中,可通过明显的颜色变化或产生气体来观察氧化剂的活性。
2.**还原剂的特点**:
-一般来说,好的还原剂具有较低的电负性,容易失去电子。
-反应后还原剂的氧化态会增高(例如从+2升至+3)。
-还原剂的活性也可以通过气泡或温度变化等现象显示出来。
三、记忆口诀
为了更易于记忆氧化剂和还原剂的特性,可以使用以下几个口诀:
1.**氧化剂口诀**:
-“氧化剂,强电负,带走电子变得柔。”意味着氧化剂具有较强的电负性,能很有效地夺取其他原子的电子,而且会接受电子而变得更加柔和。
-“一氧化二还原,离开后,原子显现。”说明氧化剂和还原剂一旦发生反应,它们之间会发生明显的状态变化,经过反应后的原子状态会更加显现。
2.**还原剂口诀**:
-“还原剂,电负弱,提供电子更勇敢。”表示还原剂通常具有较低的电负性,能主动提供电子进行还原。
-“二氧化一添加,只有这样反应佳。”强调在很多化学反应中,各种物质的加入都可能带来更好的反应效果,而还原反应中,充分的还原剂是必不可少的。
总结
经过以上的介绍,我们可以更清晰地理解氧化剂和还原剂的基本定义和性质,同时用口诀来帮助记忆。这一知识不仅在学习化学的过程中极为重要,而且在实践中也能帮助我们推断化学反应的结果。掌握了这一基本知识后,我们能够更好地理解日常生活中的许多化学现象,如生物呼吸、燃烧等反应过程。希望本篇文章对你在理解氧化剂和还原剂上有所帮助,也希望你能通过口诀的方式,更加轻松地进行化学学习和应用。
云作文原创内容,未经允许不得转载。